国内免疫球蛋白A(IgA)肾病治疗赛道诞生爆款单品天宇配资,引发制药巨头加速入局。
近日,CDE官网显示,大冢制药的斯贝利单抗注射液上市申请获得受理,拟用于原发性IgA肾病成人患者,以维持肾脏功能。此前该适应症已被纳入优先审评。
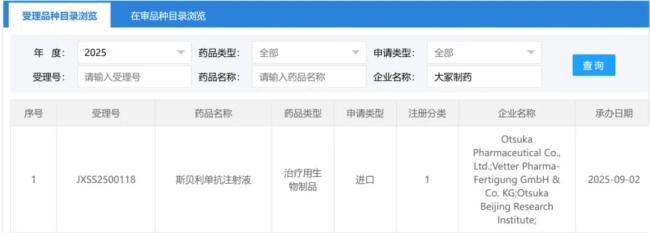
目前,全球只有四款针对IgA肾病的药物获批上市,分别是诺华制药的阿曲生坦、伊普可泮,百时美施贵宝(BMS)/Travere Therapeutics的司帕生坦,云顶新耀/Calliditas的布地奈德肠溶胶囊(商品名:耐赋康®),均为化学药。此外,还有十余款药物正处在临床阶段。
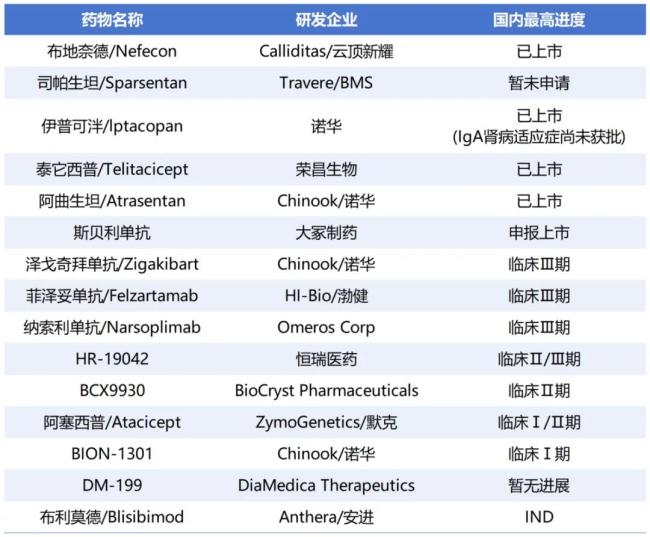
全球及国内IgA肾病管线(部分)
值得注意的是,作为肾病治疗领域的大单品,云顶新耀引进的布地奈德肠溶胶囊在今年上半年曾一度脱销。嗅到市场机会的制药巨头,正在加快涌入这一赛道。
全球IgA肾病治疗格局重塑
IgA肾病是全球最常见的原发性肾小球疾病类型,并且是慢性肾脏病(CKD)和肾衰竭的主要原因。《中国IgA肾病患者诊疗现状蓝皮书》显示,目前,我国有400多万IgA肾病患者,主要集中在青壮年。
尽管IgA肾病的特征是肾活检组织病理以IgA沉积为主,但其临床及病理特点存在显著异质性。公开资料显示天宇配资,IgA肾病进展风险高,大多数IgA肾病患者在诊断后10~15年内进展至肾衰竭,亟需创新疗法解决临床治疗困境。
据悉,大冢制药此番申报上市的斯贝利单抗原先是由Visterra开发的一款靶向抑制增殖诱导配体(APRIL)的单抗,可选择性结合并抑制APRIL的活性,在四重打击过程中发挥关键作用。
2018年7月,大冢制药以4.3亿美元的价格收购Visterra,将斯贝利单抗收入囊中。2025年5月,大冢制药宣布FDA已接受斯贝利单抗用于治疗IgA肾病的BLA申请,给予优先审查。该项BLA申请主要基于Ⅲ期VISIONARY研究和Ⅱ期ENVISION研究数据支持。
在VISIONARY研究中,与安慰剂相比,斯贝利单抗在治疗9个月后,24小时尿蛋白/肌酐比值(uPCR)水平显著降低,且具有统计学和临床意义。此外,斯贝利单抗的FDA处方药使用者费用法案(PDUFA)日期为2025年11月28日。
事实上,在大冢制药之前,BMS/Travere、诺华等制药巨头已经抢占了IgA肾病治疗领域的市场先机。
司帕生坦Sparsentan(商品名:Filspari®)最早在2005年由BMS团队初步开发(代号BMS-346567),是一种融合了血管紧张素Ⅱ受体拮抗剂厄贝沙坦(irbesartan)和内皮素受体拮抗剂联苯磺酰胺结构的首创口服双重拮抗剂,后来项目被Retrophin公司(Travere Therapeutics)收购。
由于降尿蛋白效果卓著,2023年2月FDA加速批准司帕生坦用于治疗尿蛋白/肌酐>1.5g/g的IgA肾病。2024年9月,基于该药在PROTECT研究中表现出的肾功能保护作用,FDA取消了蛋白尿的限制,全面批准司帕生坦用于治疗有进展风险的IgA肾病,使其成为唯一获得该适应症的非免疫抑制药物。Travere Therapeutics财报显示,2024年Filspari®销售额为2.27亿美元。

2024年5月,诺华公布了其开发的阿曲生坦治疗IgA肾病患者的Ⅲ期ALIGN研究的预定中期分析结果。2025年4月,阿曲生坦首次获FDA加速批准用于IgA肾病。四个月后,阿曲生坦在中国获批上市,用于降低有疾病进展风险的IgAN成人患者的蛋白尿。这是国内首个获批治疗IgA肾病的非免疫性疗法,也是国内首个且目前唯一针对该适应症的高选择性内皮素A(ETA)受体拮抗剂,有望重塑IgA肾病治疗基石。
 天宇配资
天宇配资
截图来源:诺华官微
Insight数据库显示,在IgA肾病领域,除获批上市的阿曲生坦外,诺华还有3款产品,旨在针对不同的IgA肾病驱动因素,为患者群体提供多样化的治疗选择。
2024年8月,诺华的伊普可泮获FDA加速批准用于IgA肾病,并于同月在国内递交了用于IgA肾病的新适应症上市申请;与斯贝利单抗相似,诺华也布局了一款靶向APRIL的IgA肾病新药泽戈奇拜单抗,目前正处于Ⅲ期临床阶段。诺华的第三款针对IgA肾病治疗领域的菲泽妥单抗是其以29亿美元收购Morphosys获得的CD38单抗,天境生物拥有其大中华区权益。此前,该药主要用于治疗多发性骨髓瘤,2025年1月其上市申请获CDE受理,IgA肾病适应症正处于Ⅲ期临床阶段。
业内观点分析认为,随着多款药物的获批,IgA肾病治疗领域迎来重大突破。从机制研究到临床转化,新型靶向药物正逐步改变传统治疗格局。这些进展不仅印证了临床价值,更标志着IgA肾病治疗正从免疫抑制转向精准靶向时代,为延缓疾病进展提供了全新选择。
爆款创新药吸引巨头围猎
弗若斯特沙利文数据显示,全球IgA肾病治疗药物市场保持快速增长,预计从2020年的5.67亿美元增至2025年的11.96亿美元,2020年至2025年复合年增长率达16.1%。其中,中国的IgA肾病治疗药物市场预计也将从2020年的0.37亿美元增至2025年的1.09亿美元,复合年增长率达24.6%。
值得关注的是,在国内市场上,云顶新耀引进的布地奈德肠溶胶囊表现出色。
2019年6月,云顶新耀与Calliditas Therapeutics签订独家授权许可协议,获得在大中华地区和新加坡开发以及商业化布地奈德肠溶胶囊的权利。该协议于2022年3月扩展,将韩国纳入云顶新耀的授权许可范围。
而后,布地奈德肠溶胶囊于2023年11月通过优先审评程序正式获得NMPA的批准,用于治疗具有进展风险的原发性IgA肾病成人患者,补上国内从疾病源头治疗IgA肾病的拼图,并在2024年11月被纳入国家医保药品目录,进一步扩大了其可及性。
2025年5月,布地奈德肠溶胶囊获得NMPA完全批准,取消了对蛋白尿水平的限制,适用于绝大部分IgA肾病患者的治疗。目前,布地奈德肠溶胶囊已在云顶新耀所有授权区域获得批准。
根据财报,布地奈德肠溶胶囊今年上半年销售收入达3.03亿元,同比增长81%,一度脱销。在扩产补充申请获批后,云顶新耀的供应能力进一步提升,该产品在1-8月销售收入已达8.25亿元。恢复正常供应后,布地奈德肠溶胶囊的8月单月销售收入达5.20亿元。
云顶新耀预计,布地奈德肠溶胶囊的全年销售额将达12-14亿元,并将在2026年继续保持高速增长,预计将达24-26亿元。
布地奈德肠溶胶囊月销5亿元的消息一出便吸引来行业热切关注,越来越多的本土竞争对手也将接踵而至。
8月27日,荣昌生物宣布其自主研发的全球首创BLyS/APRIL双靶点融合蛋白创新药泰它西普(商品名:泰爱®)用于治疗IgA肾病的国内Ⅲ期临床研究,达到A阶段的主要研究终点。研究结果显示,与安慰剂组相比,泰它西普组患者在治疗39周时24小时尿蛋白肌酐比值(UPCR)降低了55%(P<0.0001),且表现出良好的耐受性和安全性。荣昌生物表示将尽快向CDE递交该适应症的上市申请,详细数据将在国际重大学术会议上公布。

2024年10月,根据中国药物临床试验与信息公示平台官网,恒瑞医药正在针对HR19042胶囊开展两项临床研究,分别为一项治疗自身免疫性肝炎的有效性和安全性研究的Ⅱ期临床研究,以及一项治疗原发性IgA肾病的Ⅱ/Ⅲ期临床研究。据恒瑞医药公告介绍,HR19042是一款口服胶囊剂,能增强内皮细胞、平滑肌细胞和溶酶体膜的稳定性,抑制免疫反应和降低抗体合成,从而使组胺等过敏活性介质的释放减少和活性降低。
不难看出,当前IgA肾病创新药依然十分稀缺天宇配资,当前该领域正呈现“创新药稀缺-临床需求迫切-资本加速涌入”的良性循环,推动全球药企通过并购与研发多维度竞逐,未来市场空间广阔极具潜力,鹿死谁手,未成定局。
盛鹏配资提示:文章来自网络,不代表本站观点。